Термодинамика – это наука, изучающая законы, связанные с превращением тепловой энергии в механическую работу и наоборот. В основе термодинамики лежат два основных закона: первый и второй.
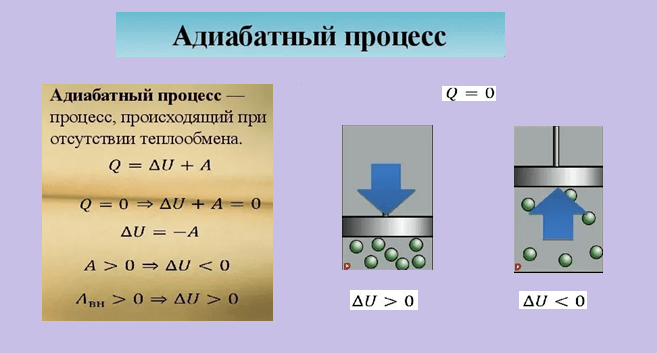
Первый закон термодинамики устанавливает важнейший принцип сохранения энергии. Согласно этому закону, энергия не может быть создана или уничтожена, она может лишь преобразовываться из одной формы в другую. Таким образом, если система получает тепло, она при этом отдает часть своей энергии в виде работы, и наоборот.
Другой фундаментальный принцип в термодинамике – это второй закон термодинамики. Второй закон термодинамики гласит, что тепло всегда переходит от объекта с более высокой температурой к объекту с более низкой температурой. Это явление называется теплопередачей и является необратимым процессом.
Оба этих закона находят применение во многих областях науки и техники. Они объясняют ряд явлений, таких как работы двигателей внутреннего сгорания, процессы перекачки жидкостей и газов, а также поведение вещества при изменении температуры и давления.
Первый закон термодинамики: определение и основные принципы
Первый закон термодинамики может быть записан математически следующим образом:
ΔU = Q — W
где ΔU — изменение внутренней энергии системы, Q — количество теплоты, полученной или отданной системой, W — работа, совершенная над системой.
Этот закон имеет большое практическое значение и применяется во многих областях науки и техники. Он позволяет анализировать и понимать процессы преобразования энергии, такие как сжигание топлива в двигателях, получение электроэнергии в электростанциях или тепловые процессы в холодильниках и кондиционерах.
Кроме того, первый закон термодинамики позволяет установить связь между теплотой и работой, а также между внутренней энергией системы и изменением ее состояния. Важно отметить, что энергия, переданная в виде теплоты, может быть полностью превращена в работу или использована для изменения внутренней энергии системы.
Таким образом, первый закон термодинамики является фундаментальным принципом, который описывает сохранение энергии в различных формах и позволяет анализировать и прогнозировать различные процессы и явления, связанные с энергией. В дальнейшем он служит основой для формулирования и понимания второго закона термодинамики.
Энергия и ее сохранение
Одним из основных принципов физической науки является закон сохранения энергии. Согласно этому закону, энергия не создается и не исчезает, а только превращается из одной формы в другую. Это означает, что сумма энергии в замкнутой системе остается постоянной во времени.
Первый закон термодинамики, или принцип сохранения энергии, утверждает, что изменение внутренней энергии системы равно сумме работы, совершенной над системой и теплоты, переданной в систему. Если внешней работой не занимаются и только выполняется перекачка теплоты (например, происходит нагревание или охлаждение системы), то изменение внутренней энергии будет равно переданной теплоте.
Второй закон термодинамики, или принцип энтропии, утверждает, что энтропия изолированной системы всегда будет увеличиваться во времени. Энтропия — это мера беспорядка или хаоса в системе. Таким образом, в открытых системах, энергия может потеряться в виде тепла, а энтропия всегда будет увеличиваться.
Законы термодинамики имеют огромное значение во многих областях науки и техники, таких как теплотехника, энергетика, физика полупроводников и др. Соблюдение этих законов позволяет предсказывать и объяснять различные явления, происходящие в природе и технике.
Таким образом, энергия и ее сохранение являются фундаментальными понятиями в физике и имеют огромное значение для понимания и описания различных процессов в природе и технике.
Внутренняя энергия и ее изменение
Изменение внутренней энергии системы может происходить вследствие различных процессов, таких как теплообмен, совершение работы, химические реакции и изменение состояния вещества.
Проведенные исследования привели к формулированию первого закона термодинамики, который утверждает, что изменение внутренней энергии системы равно сумме теплоты, подведенной к системе, и работы, совершенной над системой:
ΔU = Q — W
где ΔU — изменение внутренней энергии, Q — теплота, подведенная к системе, W — работа, совершенная над системой.
Второй закон термодинамики указывает на необратимость процессов и утверждает, что в изолированной системе энтропия всегда увеличивается или остается постоянной.
Понимание внутренней энергии и ее изменения играет важную роль в различных областях, таких как теплотехника, химия, физика и энергетика. Термодинамические принципы позволяют анализировать и оценивать энергетические процессы, оптимизировать системы и разрабатывать новые технологии.
Работа и тепловой обмен в системе
Работа может быть выполнена механически, через перемещение объектов или вращение вала, а также электрически, при передаче зарядов или генерации электромагнитных полей. Она может быть полезной, например, в случае работы двигателя или транспортного средства, или же не полезной, например, в случае трения или сопротивления.
Тепловой обмен, с другой стороны, связан с передачей энергии через тепло. Он может осуществляться путем переноса тепла от более горячего объекта к более холодному или наоборот. Тепловой обмен в системе может быть равновесным, если температуры всех объектов в системе одинаковы, или же неравновесным, если происходит перенос тепла от объекта с более высокой температурой к объекту с более низкой температурой.
Работа и тепловой обмен в системе тесно связаны между собой и влияют на энергетические процессы в системе. Например, работа может быть преобразована в теплоту или наоборот. Важно учитывать эти процессы при рассмотрении первого и второго законов термодинамики и применении их в различных областях, таких как машиностроение, энергетика и климатические системы.
Второй закон термодинамики: принципы и утверждения
Первое утверждение второго закона термодинамики — это принцип Клаузиуса. Он гласит, что теплота не может самопроизвольно переходить от холодного тела к горячему телу без внешнего воздействия. Это утверждение объясняет, почему теплота всегда переходит от тела с более высокой температурой к телу с более низкой температурой.
Второе утверждение второго закона термодинамики — это принцип Кельвина-Планка. Он утверждает, что невозможно создать машину, которая без внешнего воздействия будет целиком преобразовывать теплоту в работу. Это означает, что всегда будет некоторая часть выделяющейся теплоты, которая не может быть превращена в полезную работу.
Оба утверждения второго закона термодинамики указывают на неравновесность природы и присутствие непрерывного убывания энергии в системе. Эти принципы находят своё применение в различных областях, например, в процессах конверсии энергии, производстве электроэнергии и оценке эффективности тепловых двигателей.
Необратимые и обратимые процессы
В термодинамике процессы могут быть классифицированы на обратимые и необратимые. Обратимые процессы характеризуются тем, что они могут проходить в обратном направлении без изменения системы и окружающей среды. Необратимые процессы, в свою очередь, не могут быть обращены и протекают только в одном направлении.
Основной признак необратимых процессов заключается в наличии необратимых потерь энергии, например, в виде тепловых потерь или трения. При необратимом процессе система претерпевает необратимые изменения, а окружающая среда может испытывать изменения в своем состоянии, такие как изменение температуры или давления.
На практике большинство физических и химических процессов являются необратимыми. Например, сгорание топлива внутреннего сгорания или расширение газа через сопло. В обратимых процессах потери энергии отсутствуют, и система может вернуться в исходное состояние без изменений.
Различие между обратимыми и необратимыми процессами имеет важное значение в термодинамике. Он определяет эффективность работы различных устройств и систем, а также позволяет определить, какие процессы могут проходить самопроизвольно и обратимо.
Применение принципов обратимых и необратимых процессов в технологии и инженерии позволяет оптимизировать энергетические системы и повысить их эффективность. Знание этой классификации позволяет инженерам и ученым разрабатывать новые методы и технологии для организации энергетических процессов с минимальными потерями и максимальной эффективностью.
Энтропия и ее изменение
В соответствии с первым законом термодинамики, энтропия изолированной системы может только увеличиваться или оставаться постоянной. Второй закон термодинамики утверждает, что энтропия всегда увеличивается в закрытой системе при естественных процессах.
Изменение энтропии в системе можно выразить следующим образом:
ΔS = Q/T
Где ΔS обозначает изменение энтропии, Q — количество тепла, переданного или полученного системой, а T — температура системы.
Если система получает тепло (Q > 0) и температура остается постоянной, то энтропия системы увеличивается. Если система отдает тепло (Q < 0) и температура остается постоянной, то энтропия системы уменьшается. Если система находится в тепловом равновесии с окружающей средой, то теплообмен происходит до тех пор, пока энтропия системы и окружающей среды не станет равной.
Энтропия также может быть использована для описания качества энергии. К примеру, высококачественная энергия имеет большую сопутствующую энтропию, а низкокачественная энергия имеет меньшую сопутствующую энтропию.
Понимание энтропии и ее изменения является важным для понимания принципов термодинамики и различных процессов, происходящих в естественных системах.
Вопрос-ответ:
Что такое первый закон термодинамики?
Первый закон термодинамики, также известный как закон сохранения энергии, утверждает, что энергия не может быть создана или уничтожена, она может только изменять свою форму или передаваться от одной системы к другой.
Какой принцип лежит в основе второго закона термодинамики?
Основной принцип второго закона термодинамики гласит, что энтропия изолированной системы всегда стремится увеличиваться или оставаться одним и тем же в процессе нереверсибельных изменений.
Как можно применить первый закон термодинамики?
Первый закон термодинамики может быть применен для анализа энергетических процессов. Например, с помощью него можно определить изменение внутренней энергии системы, работу, совершаемую системой, или поток тепла между системой и окружающей средой.
Какие примеры можно привести в применении второго закона термодинамики?
Второй закон термодинамики может объяснить, почему тепло не может самопроизвольно переходить с холодного тела на горячее, почему водопад может привести к производству электроэнергии, а также почему эффективность тепловых двигателей ограничена.
Как изменение энтропии связано с применением второго закона термодинамики?
Изменение энтропии является показателем степени неупорядоченности или беспорядка системы. Второй закон термодинамики утверждает, что в изолированной системе энтропия всегда будет увеличиваться или оставаться одним и тем же в результате необратимых процессов, но никогда не уменьшаться.
Какие принципы лежат в основе первого закона термодинамики?
Первый закон термодинамики утверждает, что энергия не может быть создана или уничтожена, она может только преобразовываться из одной формы в другую.












Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.