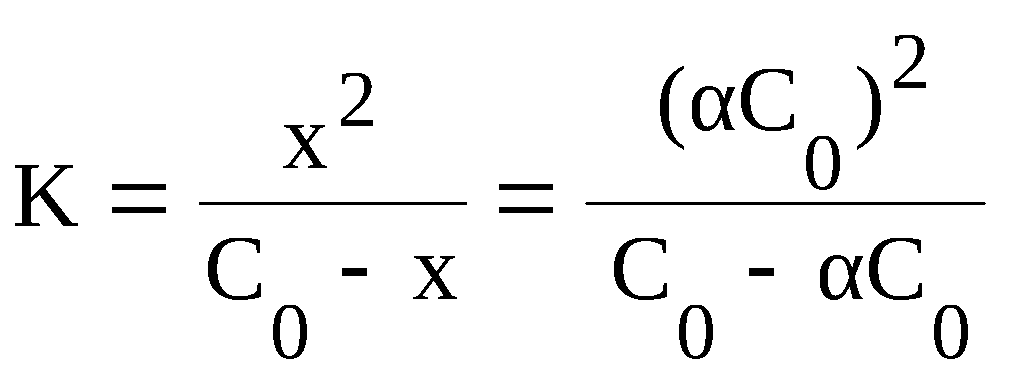
Закон Оствальда – это фундаментальная концепция в химии, которая помогает объяснить поведение реакций и равновесия в различных системах. Этот закон был сформулирован немецким химиком Вильгельмом Оствальдом в конце XIX века и стал одним из ключевых принципов химической термодинамики.
По сути, основной идеей закона Оствальда является то, что скорость химической реакции пропорциональна концентрации реагентов. Следуя этому принципу, Оствальд установил, что в равновесной системе концентрации реагентов и продуктов достигают определенного значения, при котором скорость прямой и обратной реакции становится равной. Это приводит к образованию динамического равновесия и постоянству концентраций веществ в системе.
Важно отметить, что закон Оствальда формулируется для идеальных реакций, когда все вещества находятся в растворенном состоянии и не происходит изменения давления и температуры. Также следует учитывать, что в реальных условиях закон Оствальда может не соблюдаться из-за различных факторов, таких как катализаторы или различные реакции в системе.
Определение и сущность
Сущность закона Оствальда заключается в том, что при равновесии газовой смеси, соотношения парциальных давлений каждого газа в смеси пропорциональны их коэффициенту реактивности. Другими словами, давление каждого из компонентов газовой смеси зависит от его реактивности и концентрации.
Остановка прямотока
Перед тем как приступить к проведению реакции, необходимо обеспечить условия, при которых молекулы смогут вступить во взаимодействие. Для этого катализатор должен быть добавлен к реакционной смеси. Обеспечив условия для инициирования реакции, катализатор запускает цепные процессы, которые приведут к преобразованию исходных веществ в конечные продукты.
Остановка прямотока также позволяет контролировать скорость реакции. Если требуется произвести реакцию в более медленном темпе, можно увеличить количество катализатора или проводить реакцию при низкой температуре. В случае, когда требуется ускорить реакцию, можно использовать более активный катализатор или повысить температуру.
Остановка прямотока является важной стратегией в химическом синтезе и позволяет получать широкий спектр веществ с помощью различных катализаторов. Применение Закона Оствальда и принципа остановки прямотока позволило существенно улучшить процессы синтеза в различных отраслях промышленности.
| Преимущества остановки прямотока |
|---|
| — Возможность контролировать скорость реакции |
| — Получение широкого спектра веществ через использование различных катализаторов |
| — Улучшение процессов синтеза в промышленности |
Соотношение реакций
Закон Оствальда, также известный как Принцип Соотношения Масс или Частичное Давление, устанавливает связь между концентрациями реагентов и продуктов, а также температурой и давлением в реакционной системе.
Согласно закону Оствальда, в химической системе, находящейся в равновесии, соотношение между концентрациями и/или давлениями реагентов и продуктов остается постоянным при постоянной температуре.
Причиной соблюдения закона Оствальда является стремление системы к минимуму свободной энергии. Если концентрация одной из реакционных компонентов увеличивается, то система смещается в сторону образования продуктов. Если концентрация одного из продуктов увеличивается, система смещается в сторону образования реагентов.
Закон Оствальда позволяет прогнозировать направление протекания реакции при изменении концентраций реагентов и продуктов, исходя из их начальных концентраций и коэффициентов реакции.
Кроме того, закон Оствальда представляет собой основу для расчета равновесных концентраций и давлений, что позволяет определить положение равновесия в системе.
Принципы закона
Закон Оствальда основан на нескольких принципах, которые определяют его основные положения и направленность:
1. Принцип соотношения состояния системы с ее энергетическим потенциалом. Этот принцип утверждает, что состояние системы зависит от ее энергетического потенциала, а изменение этого потенциала влияет на изменение состояния системы.
2. Принцип прогрессивного развития систем. Закон Оствальда рассматривает системы как открытые, эволюционирующие и прогрессирующие. Он утверждает, что системы постепенно развиваются и изменяются во времени.
3. Принцип сопряжения систем. Закон Оствальда учитывает взаимосвязь и взаимозависимость различных систем. Он утверждает, что изменение одной системы может влиять на состояние и поведение другой системы и наоборот.
4. Принцип динамичности систем. Закон Оствальда рассматривает системы как динамичные и изменяющиеся со временем. Он утверждает, что системы могут находиться в разных состояниях и проходить через различные стадии развития.
5. Принцип универсальности. Закон Оствальда применим к различным системам и процессам. Он утверждает, что основные положения закона справедливы как для физических, так и для биологических, социальных и других видов систем.
Дискретность реакции
Это значит, что при проведении химической реакции все вещества, участвующие в этой реакции, должны быть в определенных пропорциях. Количество веществ, которые реагируют между собой, должно быть в определенном соотношении, иначе реакция не произойдет.
Для того чтобы правильно определить пропорции веществ, необходимо знать их молекулярные массы и молярные коэффициенты, а также учесть массы всех реагирующих веществ. Изменение любого из этих параметров может привести к изменению дискретности реакции.
Таким образом, дискретность реакции является основополагающим принципом в законе Оствальда, и обеспечивает правильный ход химической реакции.
| Принципы Закона Оствальда: |
|---|
| 1. Дискретность реакции |
| 2. Равновесие химической реакции |
| 3. Константа равновесия |
Зависимость скорости от концентрации
Закон Оствальда, также известный как закон простой диссоциации, описывает зависимость скорости реакции от концентрации реагентов. Согласно этому закону, скорость реакции пропорциональна произведению концентраций реагентов, возведенных в степени, равные их коэффициентам в уравнении реакции.
Рассмотрим пример реакции:
2A + B → C
Согласно закону Оствальда, скорость этой реакции будет зависеть от концентраций веществ A и B, и будет определяться уравнением:
V = k[A]^2[B]
где V — скорость реакции, k — постоянная скорости реакции, [A] и [B] — концентрации веществ A и B соответственно.
Из этого уравнения видно, что при увеличении концентрации веществ A и B, скорость реакции также увеличивается. Это связано с тем, что при более высоких концентрациях реагентов частицы сталкиваются между собой чаще, что приводит к увеличению числа реакций за единицу времени.
Однако, следует отметить, что зависимость скорости реакции от концентрации не всегда является прямой. В некоторых случаях может наблюдаться обратная зависимость или иная сложная зависимость. Также следует учитывать, что в реальных условиях реакции могут оказывать влияние другие факторы, такие как температура и наличие катализаторов, которые также могут повлиять на скорость реакции.
Порядок реакции
Порядок реакции может быть целым числом (0, 1, 2 и т. д.) или дробным числом. Целые значения порядка реакции указывают на прямую зависимость между скоростью реакции и концентрацией реагентов.
Если порядок реакции равен нулю, это означает, что скорость реакции не зависит от концентрации реагентов и является постоянной. В случае порядка реакции, отличного от нуля, изменение концентрации реагентов приводит к изменению скорости реакции.
Для определения порядка реакции проводятся эксперименты, в ходе которых фиксируется изменение концентрации реагентов и скорости реакции. Полученные данные анализируются и с помощью математических методов определяются значения порядка реакции.
| Порядок | Математическое выражение | Описание |
|---|---|---|
| 0 | скорость = k | Скорость реакции постоянна и не зависит от концентрации реагентов |
| 1 | скорость = k[A] | Скорость реакции прямо пропорциональна концентрации одного реагента |
| 2 | скорость = k[A]2 | Скорость реакции пропорциональна квадрату концентрации одного реагента |
| дробный | скорость = k[A]m[B]n | Скорость реакции зависит от концентрации нескольких реагентов с разными степенями зависимости |
Знание порядка реакции позволяет не только понять механизм химической реакции, но и проводить расчеты, оптимизировать условия проведения реакции и контролировать ее скорость.
Основные положения
Одним из ключевых положений закона Оствальда является то, что химическое равновесие зависит от концентраций реагентов и продуктов реакции. Если концентрация одного из компонентов изменяется, то равновесие сдвигается в сторону более редкого компонента, чтобы установить новое равновесие. Это свойство закона Оствальда является основой для понимания и управления химическими реакциями в различных промышленных и научных процессах.
Оствальд также отметил, что физические условия, такие как температура и давление, могут значительно влиять на химическое равновесие. Изменение температуры может изменять константу равновесия и направление реакции. Высокое давление также может изменять равновесие, часто способствуя образованию большего количества продуктов с большей плотностью.
Закон Оствальда имеет широкое применение в химии и позволяет ученым предсказывать, контролировать и оптимизировать химические реакции. Понимание основных положений этого закона имеет большое значение для различных отраслей промышленности и науки, включая фармацевтику, пищевую промышленность, производство материалов и многие другие.
Вопрос-ответ:
Что такое Закон Оствальда?
Закон Оствальда — это физический закон, согласно которому скорость химической реакции прямо пропорциональна концентрации реагирующих веществ. Другими словами, чем больше концентрация реактивов, тем быстрее протекает реакция.
Какова основная идея Закона Оствальда?
Основная идея Закона Оствальда заключается в том, что скорость химической реакции зависит от количества взаимодействующих молекул, а значит, от их концентрации. Чем больше молекул вещества, принимающего участие в реакции, тем больше вероятность столкновения и, следовательно, тем выше скорость реакции.
Каким образом Закон Оствальда можно использовать в практических целях?
Закон Оствальда позволяет предсказывать изменение скорости реакции при изменении концентрации реагентов. Это является важным инструментом в химической кинетике и позволяет оптимизировать условия реакции для достижения желаемого результата.
Влияет ли температура на применение Закона Оствальда?
Да, температура является одним из факторов, влияющих на применение Закона Оствальда. Повышение температуры обычно увеличивает скорость реакции, так как повышает среднюю кинетическую энергию молекул и вероятность успешных столкновений.
Может ли Закон Оствальда применяться к реакциям, не являющимся прямыми?
Закон Оствальда применим только к реакциям, протекающим по прямому механизму. Для реакций, протекающих через промежуточные стадии или с обратной реакцией, применение Закона Оствальда может быть искажено.
Что такое закон Оствальда?
Закон Оствальда, или принцип Оствальда, это физический закон, опубликованный в 1900 году немецким химиком Вальтером Оствальдом. Закон гласит: «При постоянной температуре константа равновесия химической реакции остается постоянной». В общем случае, закон Оствальда утверждает, что равномерная система со временем стремится достичь состояния равновесия, где концентрации реагентов и продуктов стабилизируются. Константа равновесия связана с термодинамическими параметрами системы и может быть использована для определения направления реакции и ее скорости.












Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.